新冠肺炎已迅速在全球蔓延,对全球公共卫生造成严重威胁并对全球经济造成严重影响。目前针对新冠主要是一些支持性和对症治疗,因此迫切需要开发抑制SARS-CoV-2感染或复制的疗法。尽管SARS-CoV-2与其他冠状病毒有相似之处。但目前仍然缺乏对SARS-CoV-2感染机制的理解以及针对新冠的潜在治疗方案。
2020年05月14日,德国法兰克福歌德大学医学病毒研究所研究团队在Nature上发表题为Proteomics of SARS-CoV-2-infected host cells reveals therapy targets的研究成果。研究人员通过蛋白质组以及翻译组等技术对病毒感染不同时间点的样本进行研究。分析表明SARS-CoV-2病毒感染重塑了宿主细胞多种核心调控通路像翻译,剪接,碳代谢和核酸代谢等,针对这些途径的小分子抑制剂可抑制病毒在宿主细胞中复制。研究不仅扩展了我们对于新冠病毒感染分子机制的理解,并鉴定了抑制病毒复制的潜在药物,为新冠临床治疗方案的开发提供新思路。

1、建立SARS-CoV-2感染人细胞实验模型
为了研究针对SARS-CoV-2的潜在抗病毒药物,研究者首先在Caco-2细胞(人结肠癌上皮细胞系)中建立了SARS-CoV-2感染的细胞培养模型,并通过检测24小时内细胞上清中的病毒RNA分子的持续增加验证了该模型的有效性。
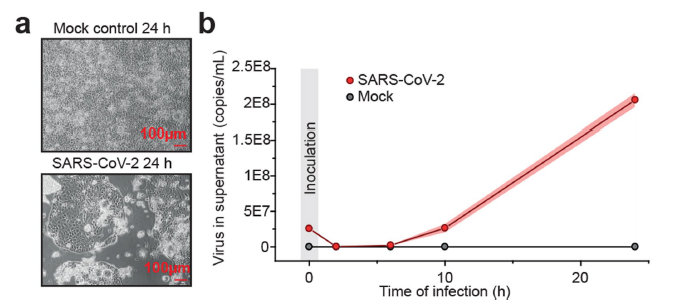
图1. SARS-CoV-2感染人细胞实验模型
2、SARS-CoV-2感染的翻译组研究
为了确定SARS-CoV-2感染的动态分布,研究者通过蛋白组以及翻译组分析了Caco-2细胞感染SARS-CoV-2在2-24小时内的变化,蛋白组和翻译组分别鉴定到了6382以及2715个蛋白。通过检测五种病毒蛋白的翻译速率发现这些蛋白均随着时间的推移不断提高,进一步的通路分析表明病毒感染后宿主翻译蛋白大量增加并检测到几个信号途径如剪接体和核苷酸合成途径的显著富集。
鉴于翻译过程的高速率,研究者推测SARS-CoV-2复制可能对翻译抑制敏感。两种翻译抑制剂-cycloheximide (翻译延伸抑制剂 )和emetine (抑制40S核糖体蛋白S14 )测试结果表明,这两种化合物在无毒性浓度下显著抑制SARS-CoV-2的复制。
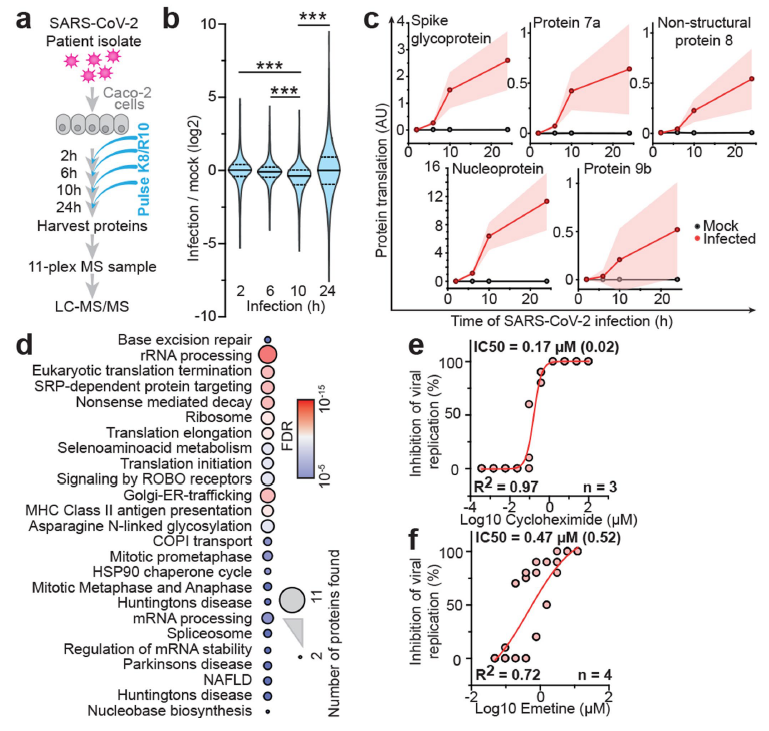
图2. SARS-CoV-2感染后宿主细胞翻译变化
3、SARS-CoV-2感染的蛋白组研究
为了进一步了解宿主感染后蛋白质组的整体变化,研究者分析了不同时间点系统中蛋白质水平的整体差异。在感染早期,宿主蛋白质组只呈现微小变化,但宿主蛋白质组在感染24小时后变化显著。聚类分析鉴定到了两类调控蛋白:第一类是由感染期间减少的蛋白质组成,富集胆固醇代谢相关蛋白;第二类由感染而增加的蛋白质组成,富集RNA修饰相关蛋白如剪接体成分和碳代谢。
鉴于宿主蛋白变化主要与RNA剪切以及代谢过程相关,研究者发现pladienolide B(剪接因子SF3B1的抑制剂)和2-DG(己糖激酶的抑制剂)能有效抑制Caco-2细胞中的SARS-CoV-2复制,揭示剪接体和糖酵解是SARS-CoV-2复制的重要途径和新冠潜在的治疗靶点。
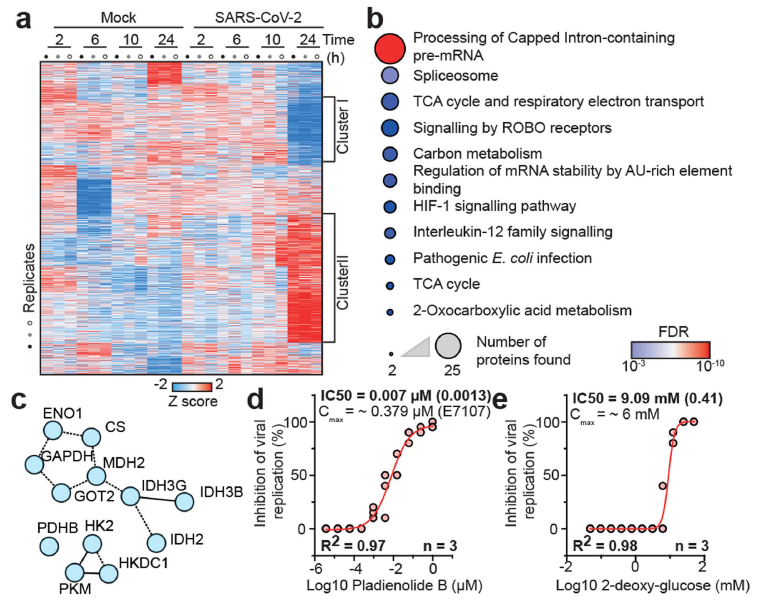
图3. SARS-CoV-2感染分析揭示病毒复制过程中的关键信号通路
之前GO分析鉴定到了与核苷酸代谢相关通路,研究人员进一步研究证实了冠状病毒的复制依赖于宿主细胞内核苷酸原料。干扰核苷酸代谢的化合物,如利巴韦林(ribavirin)能在低微摩尔和临床可达到的浓度下抑制SARS-CoV-2的复制。同时,NMS-873(一种三磷酸腺苷酶p97的小分子抑制剂)在低纳摩尔浓度下也能有效抑制SARS-CoV-2的复制,揭示这两类抑制剂可作为新冠潜在的治疗选择。
![]()
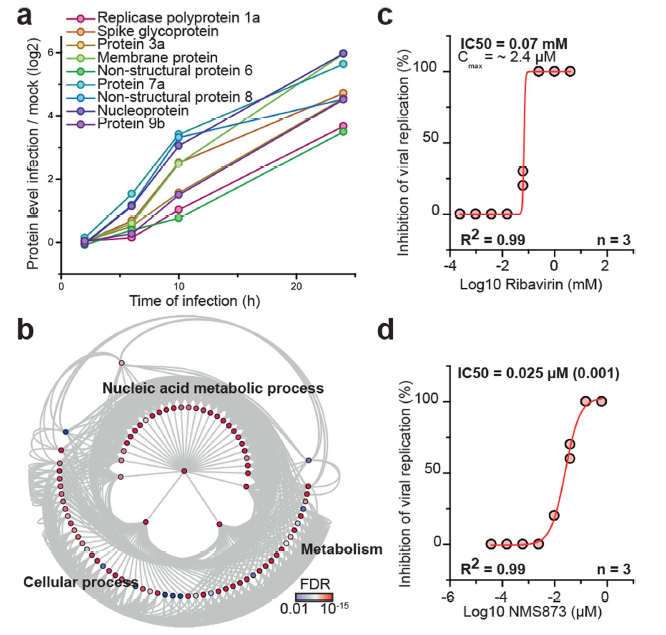
图4. 抑制SARS-CoV-2感染后宿主细胞信号通路阻止病毒复制
综上所述,本篇研究中,研究者使用定量蛋白质组学以及翻译组学技术对感染了SARS-CoV-2的宿主细胞进行研究,作者监测了感染后的不同时间点并鉴定到了宿主细胞应对感染的关键信号通路。进一步,研究者测试了靶向一些重要信号途径如翻译、蛋白水解、糖酵解、剪接和核苷酸合成的药物,发现这些药物在无毒性的浓度下可有效抑制SARS-CoV-2复制,揭示这些药物可作为新冠的潜在治疗策略。本篇研究不仅扩展了我们对于新冠病毒感染分子机制的理解,也为新冠临床治疗方案的开发提供新思路。
参考文献Denisa Bojkova, et al. (2020) Proteomics of SARS-CoV-2-infected host cells reveals therapy targets. Nature.
转载于精准医学与蛋白组学





 浙公网安备33010802007965号
浙公网安备33010802007965号